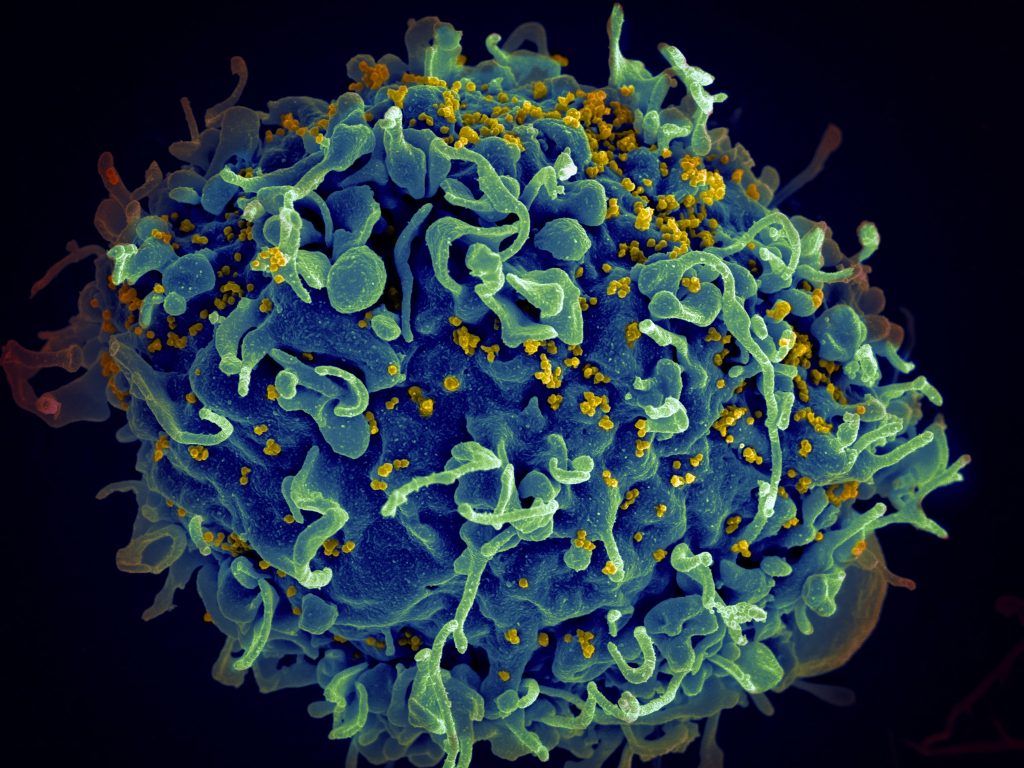
Virus lidské imunitní nedostatečnosti, známý pod zkratkou HIV (Human Immunodeficiency Virus) vstoupil do mysli každého člověka v průběhu pandemie, která nabyla globálních rozměrů začátkem 80. let minulého století. Onemocnění, které se začalo šířit napříč celým světem, nebylo snadno rozpoznatelné, projevovalo se celkovým oslabením imunitního systému, až konečnou ztrátou jakékoliv přirozené obranyschopnosti lidského organizmu vůči tzv. oportunním infekcím, kterým se běžně zdravý člověk ubrání. Pacienti, u kterých, z tehdy ještě neznámých důvodů, selhávala imunita, začali být již v roce 1981 označováni jako nemocní s AIDS (Acquired Immune Deficiency Syndrome), což v překladu znamená syndrom získaného selhání imunity. Z tehdy ještě neidentifikovaných důvodů tito lidé podléhali nejrůznějším oportunním infekcím, které jsou zapříčiněné bakteriemi, viry, a dalšími patogeny, které v lidském těle bez přirozené obranyschopnosti mohou vyvolávat různé typy rakovin, jiných život-ohrožujících stavů či infekcí ztěžujích kvalitu života. Možná nejznámější formou rakoviny, která se projevuje při AIDS, je Kaposiho sarkom. Tato specifická forma rakoviny, jíž způsobuje lidský herpesvir 8 (HHV8), se zřetelně projevuje v podobě charakteristických nafialovělých skvrn na pokožce pacientů. Sarkom však bývá agresivní a postihuje i vnitřní orgány. Podobných onemocnění, které jsou specifické pro pacienty s AIDS, je ale celá řada a byly pojmenovány jako onemocnění definující AIDS (podobné příznaky mají ale i další imunodeficientní či imunosupromovaní pacienti, jejichž imunita je požkozená či potlačená z jiných důvodů než vlivem viru HIV). AIDS dnes rovněž můžeme diagnostikovat, pokud přítomnost viru HIV v těle infikovaného snížila počet tzv. CD4+ pomocných T-lymfocytů, tj. jednoho typu buněk ze skupiny bílých krvinek, nezbytných pro normální fungování imunitního systému, pod 200/mikrolitr.
Ačkoliv AIDS začal být diagnostikován již od roku 1981, objevení původce ve formě viru HIV trvalo několik dalších let. Na virový původ onemocnění poprvé odborně poukázala studie týmu z Pasteurova Institutu ve Francii, publikovaná v časopise Science v roce 1983 (F Barré-Sinoussi et al., 1983). Tato studie nalezený virus pojmenovala LAV (Lymphadenopathy-associated virus), protože jej studovala v lymfatických uzlinách (Françoise Barré-Sinoussi & Chermann, 1985).
V dalším roce objev viru potvrdil tým z USA a přejmenoval jej na HTLV-III (Human T lymphotropic virus type III). Nezávisle na předchozích studiích virus ve stejném roce popsala i studie z Kalifornské Univerzity v San Francisku, tentokrát pod jménem ARV (AIDS-associated Retrovirus). Teprve až v následujících dvou letech další a detailnější studie potvrdily, že se jednalo o stejný virus, který až v roce 1986 Mezinárodní výbor pro klasifikaci virů virus pojmenoval jako HIV (Human Immunodeficiency Virus).
Z důvodů dlouho trvající nejistoty, celospolečenského strachu z nově objeveného viru a z důvodu rychlého šíření především mezi muži, byla tato globální pandemie od svého samého počátku doprovázena zvláště silnou a specifickou morální panikou, která v některých regionech hraničila až s hysterií. Protože tyto faktory vážně ovlivnily to, jakými způsoby epidemii HIV a nemoc AIDS vnímáme dodnes, je nezbytné jakýkoliv úvod do problematiky HIV doplnit i o diskusi některých stále málo pochopených důsledků této morální paniky. Nedostatečné zkoumání období, ve kterém morální panika z nemoci HIV vytvořila základ pro dodnes významnou křivdu vůči mnohým skupinám obyvatel, zvláště pak vůči ne-heterosexuálním mužům, představuje asi největší bariéru v poskytování zdrojů a potřebných prostředků nutných k zastavení globální pandemie HIV.
Životní cyklus HIV
Tato část příspěvku vznikla ve spolupráci s Ing. Sofií Kolibovou z Ústavu biochemie a mikrobiologie, VŠCHT v Praze, která nám, společně s Mgr. Janem Carlosem Sekerou, pomohla přeložit a nadabovat prozatím asi nejpropracovanější animaci životního cyklu HIV, díky které vám můžeme nyní i obrazem představit tento velmi složitý proces. Věříme, že porozumění tohoto procesu je základem pro možné budoucí překonání epidemie HIV, i pochopení komplikovanosti léčby osobami, které virem HIV již byly infikovány. Původní animaci v anglickém jazyce zpracovala Janet Iwasa, Ph.D. z oddělení biochemie na University of Utah, která se rovněž zabývala biologickou vizualizací na Lékařské fakultě Harvardské Univerzity.
Virus HIV patří do čeledi tzv. retrovirů
Retroviry jsou unikátní viry se schopností přepisu genetické informace z jedno-vláknové RNA do dvou-vláknové DNA. Do této skupiny virů spadá notoricky známý virus lidské imunitní nedostatečnosti, známý pod zkratkou HIV (Human Immunodeficiency Virus). Způsobuje postupné oslabení imunitní systém člověka až do té míry, že dojde k jeho významné nedostatečnosti (imunodeficiency). Tento virus zneužívá buněčného aparátu svého hostitele (člověka) pro svou vlastní replikaci (množení) a zároveň se velmi efektivně umí schovávat před imunitním systémem. Jeho životní cyklus se skládá z několika důležitých kroků, na které se snaží cílit i léky, které proti HIV máme k dispozici. Pojďme se tedy podívat co se děje když se tento virus dostane do těla člověka.
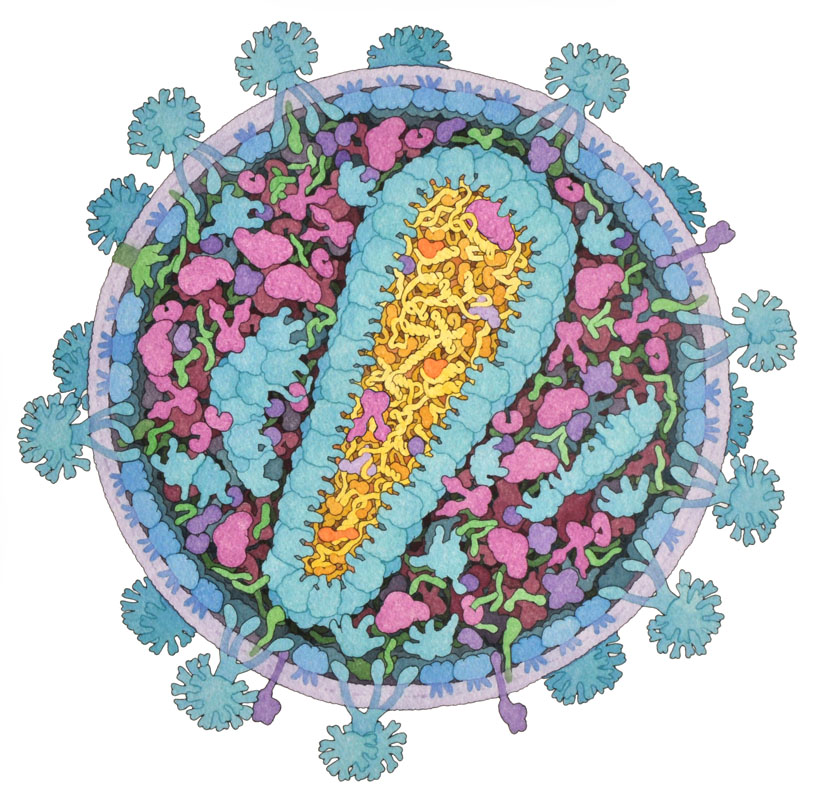
HIV se přenáší tělními tekutinami, především krví ale i spermatem, preejakulátem a vaginálními sekrety. Virová částice putuje krevním řečištěm, než narazí na jeho primární hostitelskou buňku, T-lymfocyt (virus může napadat ale i jiné buňky imunitního systému jako makrofágy a monocyty). Virus se skládá z membrány, která na sobě nese obalové proteiny, pomocí kterých se váže na cílové buňky. Dále se uvnitř viru nachází kapsida a v ní je uložený genom viru. Součástí viru jsou i další proteiny a enzymy.
Obrázek: Schematický nákres virové částice HIV / Zdroj: Cross section of mature HIV (2011, David S. Goodsell)
Životní cyklus viru začíná navázáním viru přes jeho obalové proteiny na CD4+ proteiny, které se vyskytují na povrchu cílových buněk, nejčastěji T-lymfocytů (tzv. CD4+ lymfocytů), ale také makrofágů a monocytů. Následně se naváže další membránový protein (tzv. ko-receptor). Tato vazba náhle spustí reorganizaci obalového proteinu, což způsobí konformační změnu (změnu uspořádání molekul), díky které je umožněno zanoření obalových proteinů do membrány T-lymfocytu. Následné stočení zanořeného obalového proteinu umožňuje fúzi (sloučení) virové membrány s membránou T-lymfocytu což, vede k průniku kapsidy do hostitelské buňky. Na tento krok v životním cyklu viru cílí jedna ze skupin léků (viz poznámka č. 1) používaných na HIV. Jedná se o inhibitory, které brání vazbě viru na membránové proteiny T-buněk a tím blokují vstup virové kapsidy do buňky.
(Poznámka 1: Inhibitory vstupu – působí dvojím mechanismem, buď cílí na ko-receptor na membráně T-buňky a tím brání vazbě HIV s tímto receptorem, nebo se váže na N-konec virového proteinu a tím znemožní viru infikovat hostitelskou buňku.)
Vniknutí virové kapsidy do hostitelské buňky
Zdroj: Janet Iwasa (Department of Biochemistry, University of Utah)


Když se virová kapsida dostane do hostitelské buňky, tak začíná její cesta k buněčnému jádru. K tomu aby se tam dostala tak využívá cytoskeletu buňky (dynamického systému vláken v buňce), pohybuje se podél mikrotubulů (vláken), po kterých „jede jako auto po dálnici“. Během toho co se kapsida blíží k jádru tak se v ní začíná pracovat enzym známý jako reverzní transkriptáza.
Pohyb virové kapsidy po mikrotubulu T-lymfocytu / Zdroj: Janet Iwasa (Department of Biochemistry, University of Utah)
Reverzní transkriptáza je unikátní enzym retrovirů, který dokáže přepsat svojí RNA do DNA. Aktivací toho enzymu dochází v kapsidě k přepisu virové RNA do DNA. Desítky reverzních transkriptáz pracují souběžně na vláknech RNA, aby tento proces dokončily co nejrychleji. Po ukončení přepisu obsahuje virová kapsida kompletní DNA genom, samotná kapsida se začíná rozpadat, aby mohlo dojít k uvolnění virové DNA. Toto je kritický okamžik pro virus, který musí přepsat svojí RNA do DNA, aby ji mohl zabudovat do genomu hostitelské buňky. A právě z tohoto důvodu další skupina léčiv (viz poznámka č. 2) na HIV cílí právě na reverzní transkriptasu a snaží se tak blokovat přepis virové RNA do DNA.
(Poznámka 2: Patří sem dva typy léčiv – nukleotidové inhibitory reverzní transkriptasy – jež jsou modifikovanými nukleotidy, což jsou základní stavební kameny DNA. Tyto nukleotidy neobsahují ve své molekule volnou 3’ OH skupinu což znamená, že když se do přepisované virové DNA naváže tento modifikovaný nukleotid, tak není možné za něj navázat žádný jiný a tím dojde k ukončení přepisu virové DNA. Druhým typem jsou ne-nukleotidové inhibitory reverzní transkriptasy – tedy inhibitory, které se váží přímo na enzym reverzní transkriptasu a tím znemožňují její funkci.)
Virová částice s aktivní reverzní transkriptázou přepisující jednovláknovou RNA na dvojvláknovou DNA / Zdroj: Janet Iwasa (Department of Biochemistry, University of Utah)
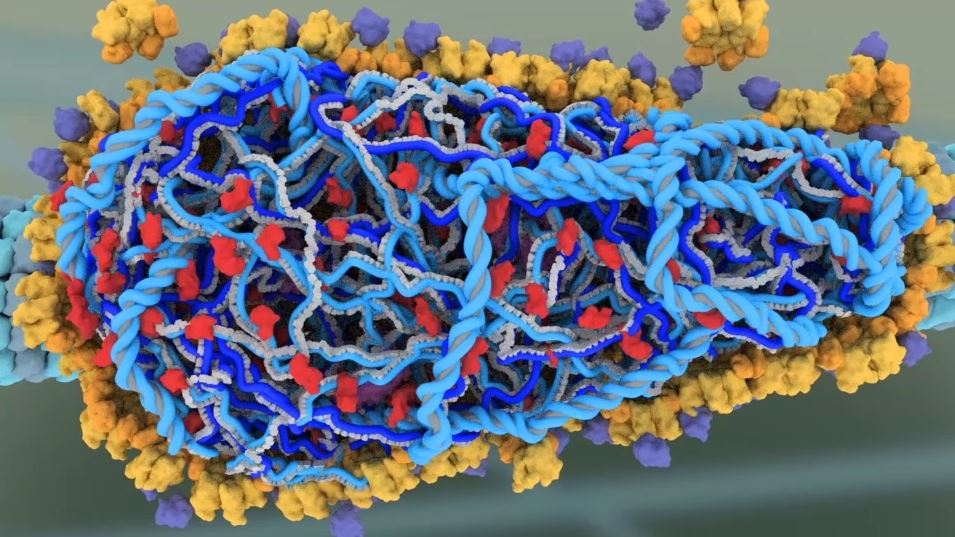
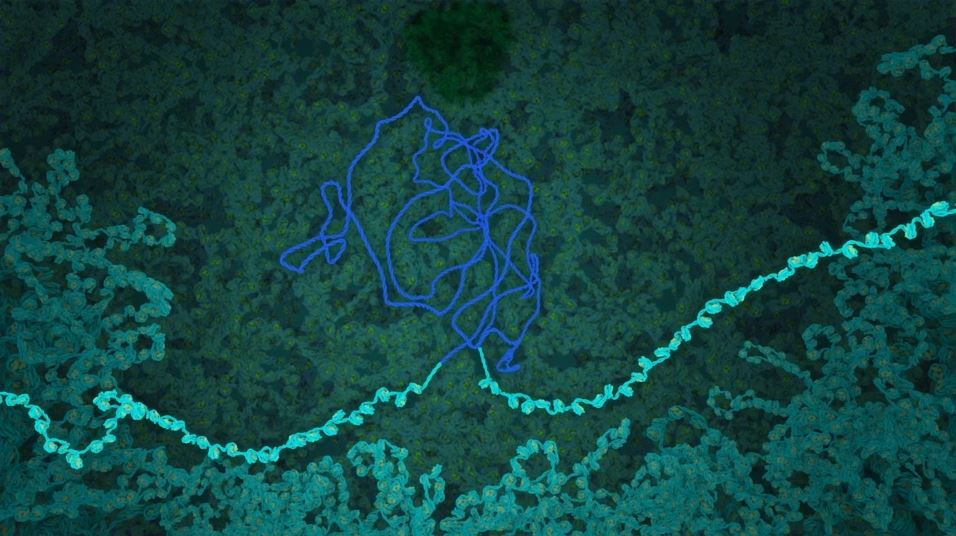
Nyní se virus dostal k jádru buňky a virová DNA postupně začne procházet jaderným pórem do nitra samotného jádra. Na virové DNA se nachází virový enzym zvaný integráza. Ta je schopná se navázat na DNA hostitelské buňky, rozstřihnout jí a vložit sem virovou DNA. Takto zabudovaná virová DNA se nazývá provirus, ten může být aktivní ihned anebo může být v nečinné fázi po dny, měsíce i roky. Na vložení virové DNA do genomu hostitele cílí další skupina léčiv na HIV, tato skupina léčiv (viz poznámka č. 3) blokuje enzym integrázu a tím se snaží zastavit vkládání virové DNA do té hostitelské.
(Poznámka 3: Inhibitory integrázy – tyto látky obsahují vazebná místa pro hořečnaté kationty a soutěží o tyto vazebná místa s integrázou a tímto mechanismem snižují aktivitu virového enzymu.)
Místo vložení virové DNA do genetické informace hostitelské buňky / Zdroj: Janet Iwasa (Department of Biochemistry, University of Utah)
Po aktivaci proviru se hostitelská buňka přeměňuje na virovou továrnu. Kdy tato mašinerie začíná přepisem virové DNA do RNA procesem transkripce (přepisu). K té je zapotřebí RNA polymeráz, které přepisují DNA do RNA. Některé virové RNA pak procházejí sestřihem, kdy z delšího prekurzoru vznikají kratší RNA vlákna. Takto vzniklé RNA transkripty můžou opustit jádro. Aby toho docílily, obsahují krátkou sekvenci, na kterou se váže protein Rev, ten poté asociuje (váže se) s buněčnými proteiny, které vedou virovou RNA ven z jádra skrz jaderný pór.
Únik nových částí virové RNA skrze jaderné póry hostitelské buňky / Zdroj: Janet Iwasa (Department of Biochemistry, University of Utah)
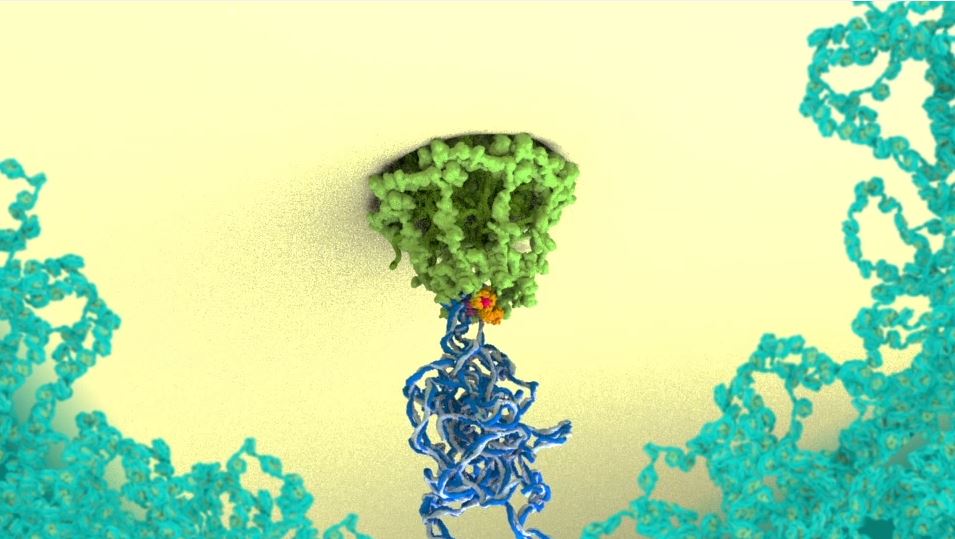
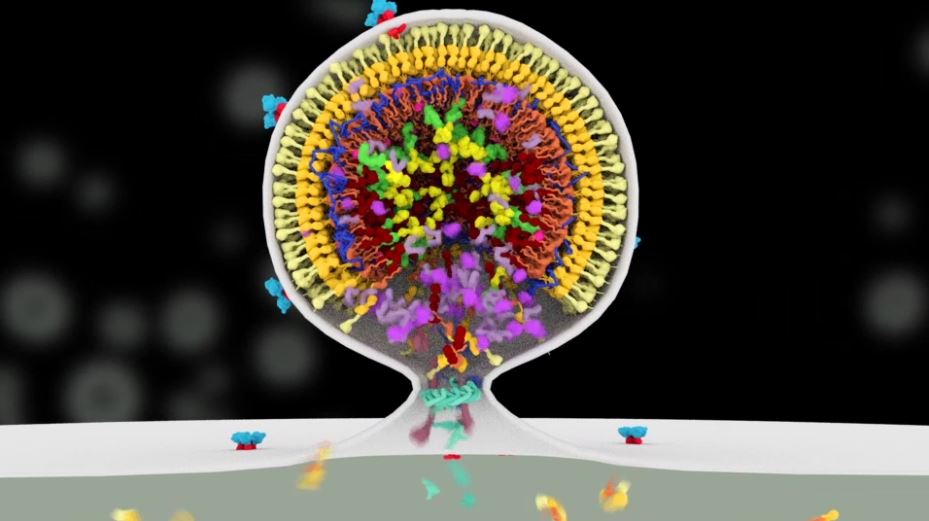
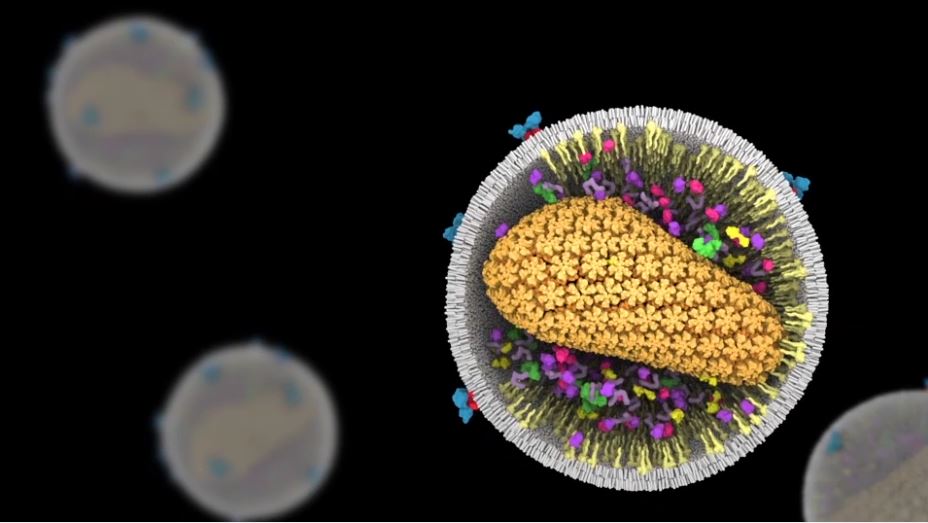
V cytoplasmě buňky (buněčné tekutině) mají virové RNA různé role. Některé části jsou určeny, aby vytvářely proteiny. Tato činnost se uskutečňuje na ribozomech (buňěčných organelách), které čtou RNA a produkují příslušné, v tomto případě virové, proteiny. V námi česky nadabovaném videu můžete vidět produkci proteinu Gag, což je strukturní protein důležitý pro vytvoření nové virové částice. Další RNA je genomová RNA retroviru, která po cestě k buněčné membráně vychytává Gag protein. Během této cesty se k sobě váží dvě kopie virové RNA, což dává vzniku stabilnější RNA struktuře zvané dimer. Na buněčné membráně se hromadí virové obalové proteiny a tisíce kopií Gag proteinů s navázanou RNA. Gag následně začne vytvářet pod membránou hustou síť a to má za následek zahájení pučení nové virové částice. Do nově pučícího váčku se dostávají další a další proteiny až v konečné fázi to uzavírají proteiny zvané ESCRT-III. Ty vytvářejí polymer, který postupně stahuje membránu k sobě, až se nakonec úplně oddělí a uvolní se virová částice.
Únik nových částí virové RNA skrze jaderné póry hostitelské buňky / Zdroj: Janet Iwasa (Department of Biochemistry, University of Utah)
Nová virová částice v tuto chvíli ještě není infekční, aby dokončila svůj cyklus, musí projít procesem maturace tzv. dozrát. Maturace je zahájena dimerizací a následným uvolněním dalšího důležitého enzymu – proteázy. Proteáza funguje jako molekulární nůžky, střihá Gag protein na specifických místech, což vede ke vzniku dalších, kratších proteinů jako je nukleokapsidový protein, který váže a stabilizuje virovou RNA. Dalším proteinem podléhajícím sestřihu je kapsidový protein, který vytváří kónickou kapsidu obalující virový komplex s RNA. Tímto se vytvoří znovu kapsida s uloženou virovou RNA. Až po procesu maturace je virus schopný absolvovat nové kolo infekce proto i sem cílí léčiva na HIV (viz poznámka č. 4), působí proti virové protease a zamezuje tak viru maturovat (dozrát) a dále se replikovat (množit).
(Poznámka 4: Inhibitory proteázy – braní sestřihu gag proteinu, vznikají pak nezralé a neinfekční virové částice.)
Únik nových částí virové RNA skrze jaderné póry hostitelské buňky / Zdroj: Janet Iwasa (Department of Biochemistry, University of Utah)
Maturací se uzavírá celý životní cyklus HIV viru. Zde popsaná problematika je pouhým zjednodušením celého cyklu viru. HIV je stále předmětem mnoha studií po celém světě, kdy se snažíme zjistit a na molekulární úrovni pochopit chování tohoto viru. Snažíme se objasnit, jakým mechanismem se mu daří schovávat se před naším imunitním systémem. Detailní pochopení jeho životního cyklu nám pak může pomoci v účinnějším boji proti tomuto záludnému patogenu.
Diagnostické okénko při testování HIV
Jak dlouho trvá tzv. diagnostické okénko, které ovlivňuje spolehlivost testování na přítomnost viru HIV? Jaká je délka diagnostického okénka, o kterém se příliš často nemluví?
Diagnostické okénko je termín, který užíváme pro časové období, které trvá mezi okamžikem potenciální expozice vůči infekci (zde HIV) a okamžikem, kdy diagnostický test poskytne přesný výsledek.
Infikovaná osoba však může být velmi infekční již během trvání období diagnostického okénka, navzdory tomu, že by v tomto období šla na test a výsledek byl negativní.
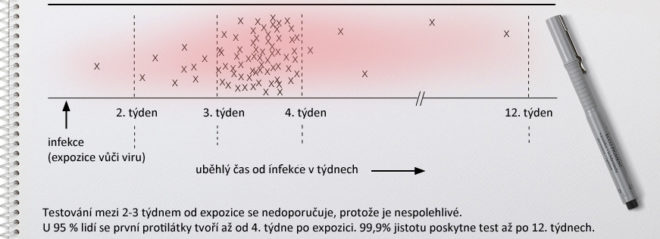
Obvyklá délka diagnostického okénka pro 4. generaci testů na protilátky jsou čtyři týdny. Po čtyřech týdnech se vytvoří v těle protilátky až u 95 % všech nově infikovaných osob (viz. obrázek). Avšak s 99,9% pravděpodobností bude test spolehlivý až po uplynutí 12 týdnů, tedy po uplynutí lhůty, kdy se protilátky vytvoří u 99,9 % ze všech lidí.
První protilátkou (antigenem), kterou lze v těle infikovaných osob zaznamenat je protilátka p24. Ta se začíná tvořit mezi 1. a 8. týdnem po expozici. Testy na přítomnost protilátky p24 však při včasném použití nejsou přesné, mohou být i negativní. Proto je potřeba nechat se testovat vždy provádět až po uplynutí diagnostického okénka, které vždy počítáme od první chvíle, kdy jsme mohli přijít do kontaktu s virem HIV.
Jen u malého množství lidí lze protilátky zaznamenat po dvou týdnech, po 4 týdnech se ukáže u 95 % případů, avšak pro 99,9% jistotu čekejte až na 12. týden.
Z toho vyplívá:
- Pokud jste se nakazili virem HIV, můžete svůj stav zjistit s 95% pravděpodobností nejdříve po 4 týdnech od možné infekce, a s 99, 9% pravděpodobností až po 12 týdnech.
- Dřívější test se Vám může mylně projevit jako negativní.
- Osoby, u kterých ještě nejsou vytvořeny protilátky, u kterých tedy nelze ještě přítomnost viru HIV potvrdit však jsou infekční již v průběhu trvání diagnostického okénka.
Literatura
- Barré-Sinoussi, F., & Chermann, J.-C. (1985). Lymphadenopathy Associated Virus (L.A.V.) : Its Association with AIDS or Prodromes (pp. 35–43). https://doi.org/10.1007/978-1-4615-9430-7_3
- Barré-Sinoussi, F., Chermann, J. C., Rey, F., Nugeyre, M. T., Chamaret, S., Gruest, J., … Montagnier, L. (1983). Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science (New York, N.Y.), 220(4599), 868–71. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/6189183
- Lodish, H., A. Berk, P. Matsudaira, K. A. Kaiser, M. Krieger, M. P. Scott, L. Zipursky a J. Darnell (2004): Molecular cell biology. 5 th W. H. Freeman and Company, New York, 973.
- Shaunak, S. & Weber, J. N. (1992): The retroviruses: classification and molecular biology. Baillieres Clin Neurol. 1, 1-21.
- Uniprot. https://www.uniprot.org/uniprot/P04591 (Acessed Aug 15, 2018)
- Wodrich, H. & Krausslich, H. G. (2001): Nucleocytoplasmic RNA transport in retroviral replication. Results Probl Cell Differ. 34, 197-217.



